
エンドトキシンはグラム陰性桿菌の細胞壁の構成成分であるリポ多糖類(LPS)であり、さまざまな生物活性を有する物質です。エンドトキシン単位はEUです。
エンドトキシンは、血液や髄液(脳脊髄液)に侵入すると発熱を引き起こし、パイロジェンとも呼ばれます。そのため、医薬品、非経口生物製剤、一部の組織培養培地からエンドトキシンを除去する必要があります。
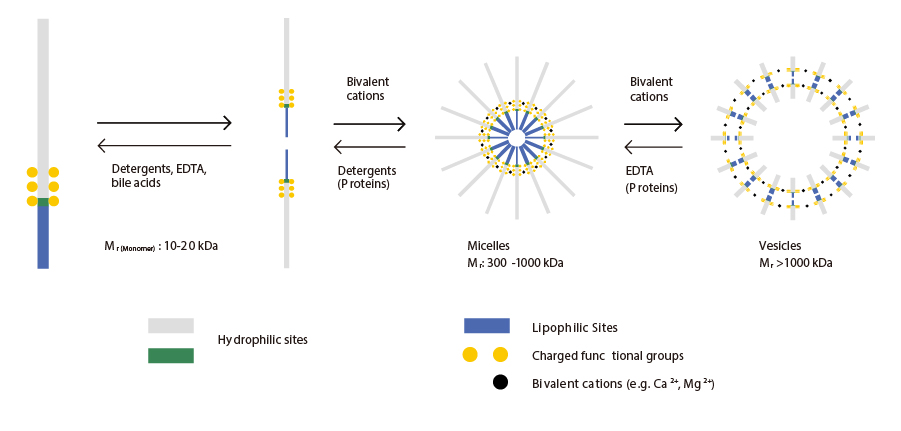
図1:異なる水溶液中のエンドトキシン凝集体の構造
図1では、溶液中のエンドトキシンの分子量が10~20kDaであることを示していますが、それらは直径0.1μmまでのミセルや小胞を形成できます。洗浄剤、キレート剤、タンパク質の存在は、ミセル(300~1000 kDa)やモノマー(10~20 kDa)のような構造の形成を促進し、二価イオンは小胞(>1000 kDa)のような大きな構造の形成を促進します。脱パイロジェン化する溶液中の標的物質が分子量の小さいもの(緩衝液、塩、ヌクレオチド、アミノ酸、ペプチド、一部の炭水化物など)であれば、適切なタンジェンシャルフロー膜パッケージを用いた限外ろ過によって、標的物質からエンドトキシンを分離することができます。しかし、エンドトキシンと同じ分子量範囲のタンパク質は限外ろ過では分離できません。
エンドトキシンは負電荷のリン酸基とカルボキシル基を含んでいるため、エンドトキシンモノマーの等電点は約2と比較的低いです。つまり、エンドトキシンはpH>2の溶液中で電気陰性度を示すため、イオン交換クロマトグラフィーはパイロジェンを除去するために一般的に使用される方法です。
従来の培地を用いたクロマトグラフィー法には、エンドトキシン除去ステップとしての使用を制限するいくつかの欠点があります。これには、乱流、低流速、煩雑な取り扱い、長い再生時間、化学的安定性の制限などの操作上および使用上の問題が含まれます。低流量でファウリングに敏感なクロマトグラフィー媒体を大規模生産の精製工程に組み込むことは、煩雑でコストもかかります。
Cobetterは、大容量、スケーラブルですぐに使用できるイオン交換膜アドソーバー(クロマトグラフィー)技術を開発しました。高速流速と大負荷容量は新製品の特徴で、ラボやプロセススケールでの熱源除去に貢献できます。

タンパク質やペプチドを含む培地や溶液の脱パイロジェン化プロトコールを設計する際には、多くの要因を考慮する必要があります。例えば、対象物質、タンパク質やペプチドの種類、生成物の濃度、分子量、等電点(pI)、溶液の導電性、pH値、緩衝システム、干渉や凝集の相互作用など。
Q強陰イオン膜交換吸着剤(クロマトグラフィー)とタンパク質のpIより低いpHの緩衝液を用いると、エンドトキシンは膜に吸着され、目的生成物は膜を通過して回収されます。
エンドトキシン除去は対数減少値(LRV)で表されます。

陰イオン交換フロースルー精製工程におけるエンドトキシン除去に関する研究
Q膜のエンドトキシン負荷量は>106EU/ml、すなわち1mlのQ膜で合計106EU以上のエンドトキシンを負荷し、負荷能力は比較的高いです。しかし、実際のバイオ医薬品用途では、供給溶液の初期エンドトキシン濃度は100EU/mlより低いことがほとんどであり、エンドトキシン除去後の供給溶液中のエンドトキシン含有量の基準は比較的高く、一般的に<0.25EU/mlを必要とします。したがって、実際の用途では、Q膜がどれぐらいエンドトキシンを減少させることができるのかが重要です。(つまり、供給溶液中のエンドトキシン負荷が低い場合には、LRV値に注目します)。
本研究在低负载条件下使用DOE实验对Q膜在去除制剂Buffer中内毒素的性能进行研究
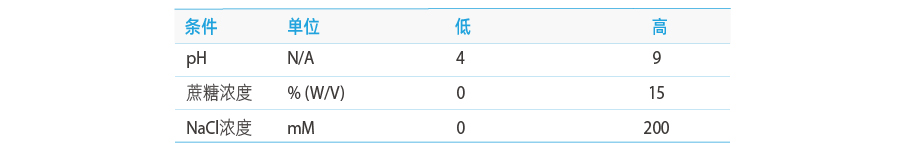
初期のスクリーニングと評価の後、最終的にpH、NaCl、ショ糖濃度をDOE実験に選択しました(Box-Behnken計画)。
因子A:pH;デザインスペース範囲4~9;
因子B: ショ糖濃度(W/V); デザインスペース範囲 0 ~ 15%;
因子C:NaCl濃度(mM);デザインスペース範囲 0 ~ 200 mM;
五つ中心点をセットし、
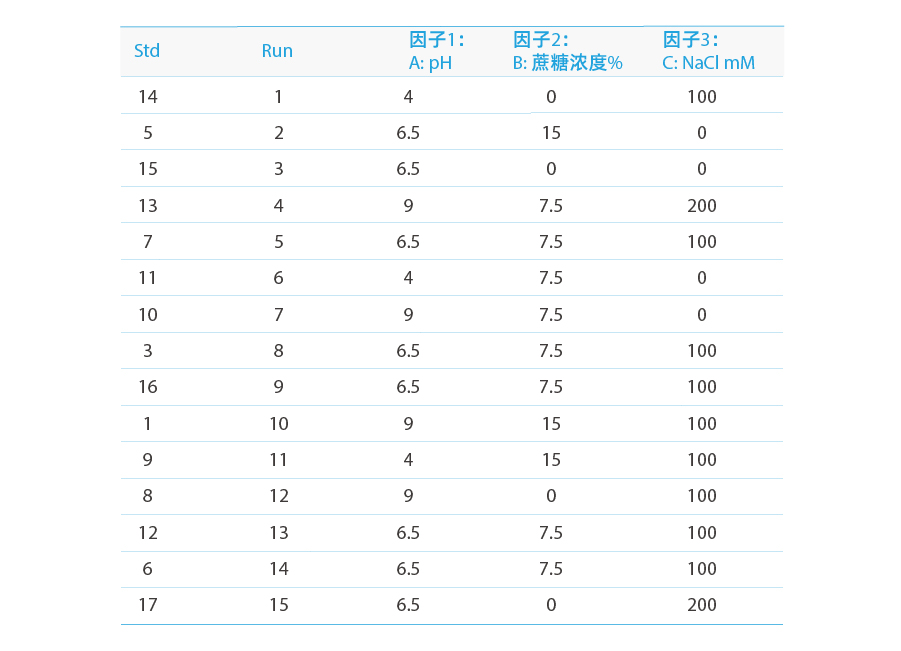
以下の表に示すように、合計17セットの実験が行われました。
実験方法
試験液のエンドトキシン濃度:100 EU/ml
Purcise™ Q膜容量:0.9 ml(16層構成)
Purcise™ Qメンブレンろ過スパイク液容量:90 ml
ろ過流量:9ml/分(10MV/分)
Q膜ろ過前後の試験液を回収し、エンドトキシン濃度を測定します
エンドトキシン除去率は対数減少値(LRV)で表します
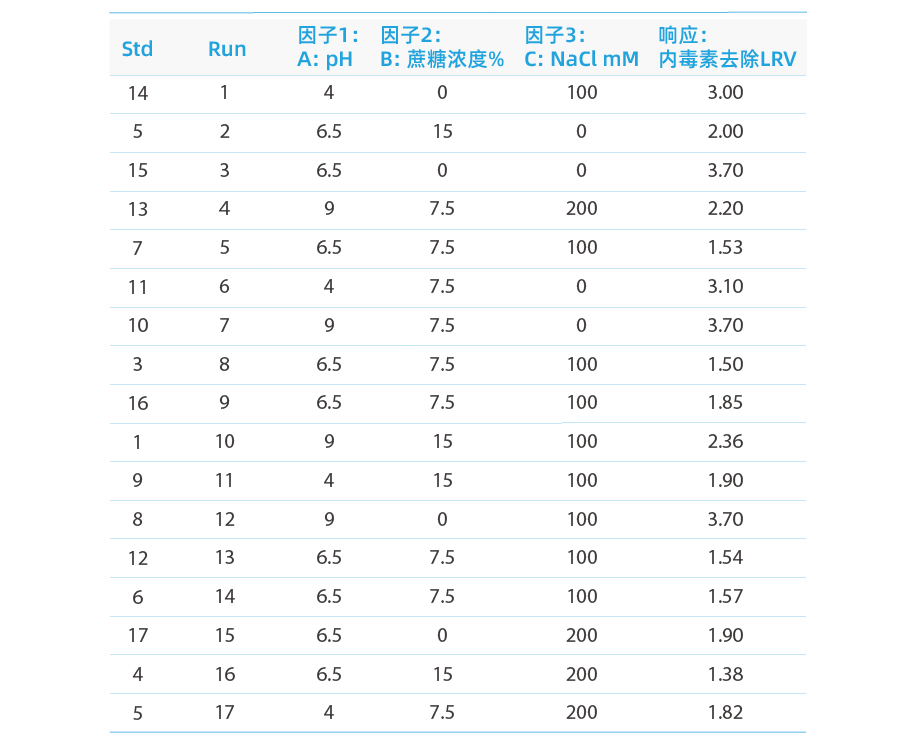
分析の結果は以下の通りです:
レスポンス エンドトキシン除去LRV値
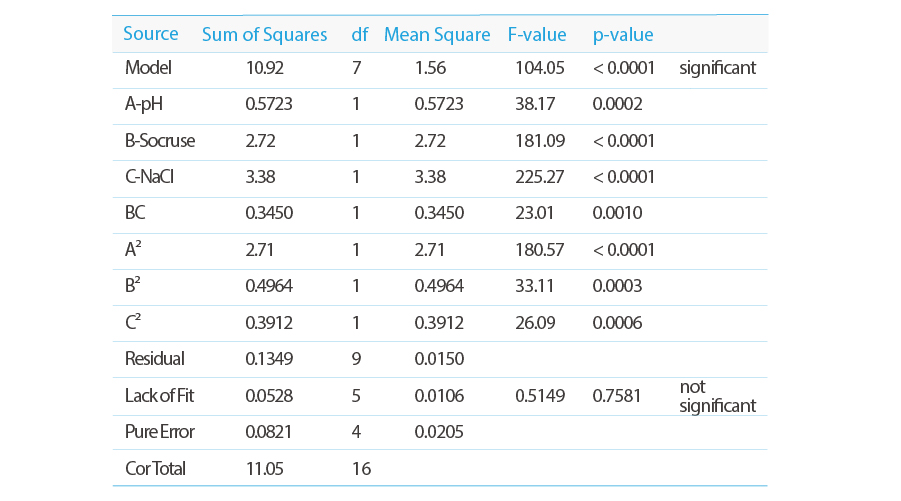
Model F-valueは104.05で、モデルが有意であることを示しています。
P-valuesは0.05より低い、モデル項が有意であることを示します。
この場合、 A、B、C、BC、A²、B²、C² が重要なモデル項です。
Lack of Fit F-valueは0.51で、これは適合の欠如が純粋誤差に対して有意ではないことを意味します。
統計データ
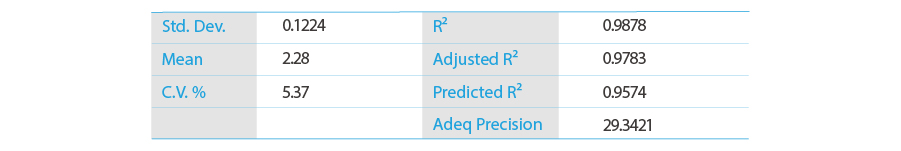
フィッティング・モデル最終式

応答曲面プロット
検証実験I
試験液の処方:50 mM Tris、50 mM NaCl、9%スクロース、pH 7.5
スパイクされた試験液のエンドトキシン濃度:43.8 EU/ml
Purcise™ Qメンブレンの容量:0.9 ml(16層構成)
Purcise™ Qメンブレンろ過スパイク液量:300 ml
ろ過流量:9 ml/min (10 MV/min)
Q膜ろ過前後の液を回収し、エンドトキシン濃度測定用サンプルを採取
その結果、エンドトキシン濃度43.8EU/mlの調製用緩衝液300mlをPurcise™ Q膜でろ過し、エンドトキシンは0.12EU/ml以下(ゲル法で測定)となり、モデル計算の予想と一致しています。圧力は初期の8.7psiから9.72psiまで上昇しました。
検証実験 II
試験液の処方:50 mM Tris、9%スクロース、pH 7.2
スパイクされた試験液のエンドトキシン濃度:16.11 EU/ml
Purcise™ Q膜容量:0.45 ml(8層構成)
Purcise™ Qメンブレンろ過スパイク液量:1500 ml
ろ過流量 9 ml/min (20 MV/min)
Q膜ろ過前後の液を回収し、エンドトキシン濃度測定用サンプルを採取
その結果、エンドトキシン濃度16.11EU/mlの調製用緩衝液1500mlをPurcise™ Q膜でろ過し、ろ過後のエンドトキシンは0.024EU/ml(速度論的比色法で測定)となり、モデル計算の予想と一致しています。
Purcise™ Q 0.45ml(8層構成)負荷圧曲線
おわりに
低負荷条件下では、Purcise QのpH、スクロース濃度、NaCl濃度が最終的なエンドトキシン除去効果に影響を与えました(P < 0.05)。その中では、NaCl濃度とスクロース濃度は、Purcise™ Q膜のエンドトキシン除去効果に相互作用があります。
低負荷条件下で実験的に検証されたPurcise™ Q膜によるエンドトキシン除去に関するDOE適合数理モデルが実際に利用可能であり、その数理モデルは以下の通りです:
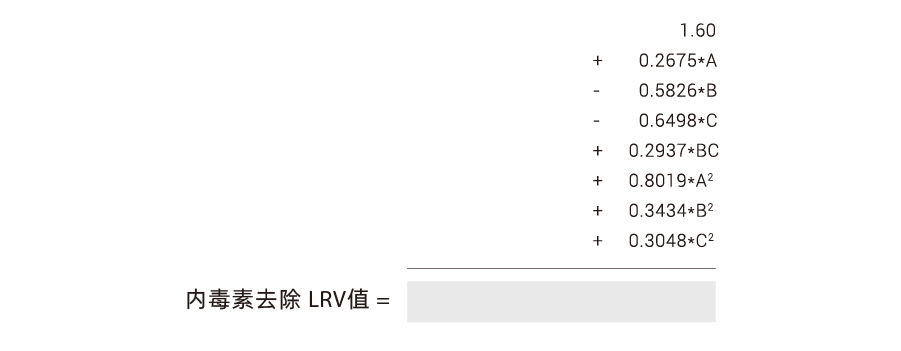
A:pH値
B:ショ糖濃度
C:NaCl濃度
低負荷条件下では、Purcise™ Q膜は適切なpHとNaCl濃度の条件でLRV>3となります。Purcise™ Q膜の最終的なLRV値は、実際の薬液成分とモデル式に基づいて計算できます。
お勧めのQ膜エンドトキシン除去条件の範囲:pH:4~9、スクロース濃度(W/V):0 ~ 9%,NaCl(mM):0 ~ 50 mM
8層構造のPurcise™ Q膜はろ過差圧が小さく、流量が速いため(推奨流量1~25MV/分、最大耐圧3bar)、高粘度製剤でも安定した流量を確保できます。
 eShop
eShop



