医薬品の製造管理及び品質管理に関する基準(GMP)」 の細胞治療製品に関するAppendixの記述には、工場、施設、設備 が製造工程に対応する環境要件を満たすことが明記されています。 また、細胞治療製品の製造工程では、品質リスクを管理するために、汚染や交差汚染を可能な限り避けるための適切な措置を講じることが求められています。
シングルユース製品は、その無菌性、気密性、柔軟性、単回使用で交差汚染のリスクを回避できるにより、規制要件を完全に満たすことができ、細胞遺伝子治療製品のプロセスにおける調製、保存、移送のニーズを満たすことができます。
CGT分野におけるシングルユース製品の品質要件
シングルユース製品は、生産材料やCGT製品自体と直接的または間接的に接触するため、シングルユース製品の生体適合性(USPクラスVIなど)、動物由来成分の不使用、無菌性(エンドトキシンおよび発熱物質の制御を含む)、抽出物および溶出物(E&L)、および不溶性粒子/汚染物質の制御基準にはより注意が払われることになります。次のセクションでは、これらの重点分野と制御対策について詳しく説明します。1.抽出物と溶出物
したがって、CGT 分野で使用されるシングルユース製品からの抽出物(潜在的な抽出物と実際の抽出物の両方を含む)を評価し、管理することが不可欠です。
*额外验证:科百特cNAS认证验证实验室,可提供客户针对其产品和接触的一次性产品进行单独的浸出物&可提取物验证测试,并提供相应验证报告文件。同时,可以根据实际工艺进行安全性评估和毒理学分析。
2.不溶性粒子・可視異物の管理
粒子状物質汚染によってもたらされるリスクの深刻さは制御できないことが多く、意図する投与経路、投与量、粒子の特性(サイズ、形状、組成、量)、粒子の標的位置などの要因によって影響されます。したがって、CGT 製品の製造における粒子状物質の管理は、この分野が現在直面している課題の 1 つです。シングルユース製品における粒子状物質の効果的な制御と最終製品における不溶性粒子の基準は、CGT 製品に適用される場合、ますます注目され、より高い要件が求められています。Cobetter のシングルユース製品 - CGT テクノロジーをサポートする
細胞培養:Cobetter Lifecask RWウェブバッグ/Lifecask RGバイオリアクションバッグ
これらの製品は細胞毒性がなく、細胞の成長を阻害しないため、細胞親和性が向上しています。複数の容量仕様で提供されており、カスタマイズされた顧客のニーズを満たすことができます。当社の膜材料とコンポーネントは社内で製造されており、安定した供給が保証されています。LAK(リンホカイン活性化キラー細胞)やCIK(サイトカイン誘導キラー細胞)などの非特異的療法、および特異的療法の培養と増殖の要件を満たしています。

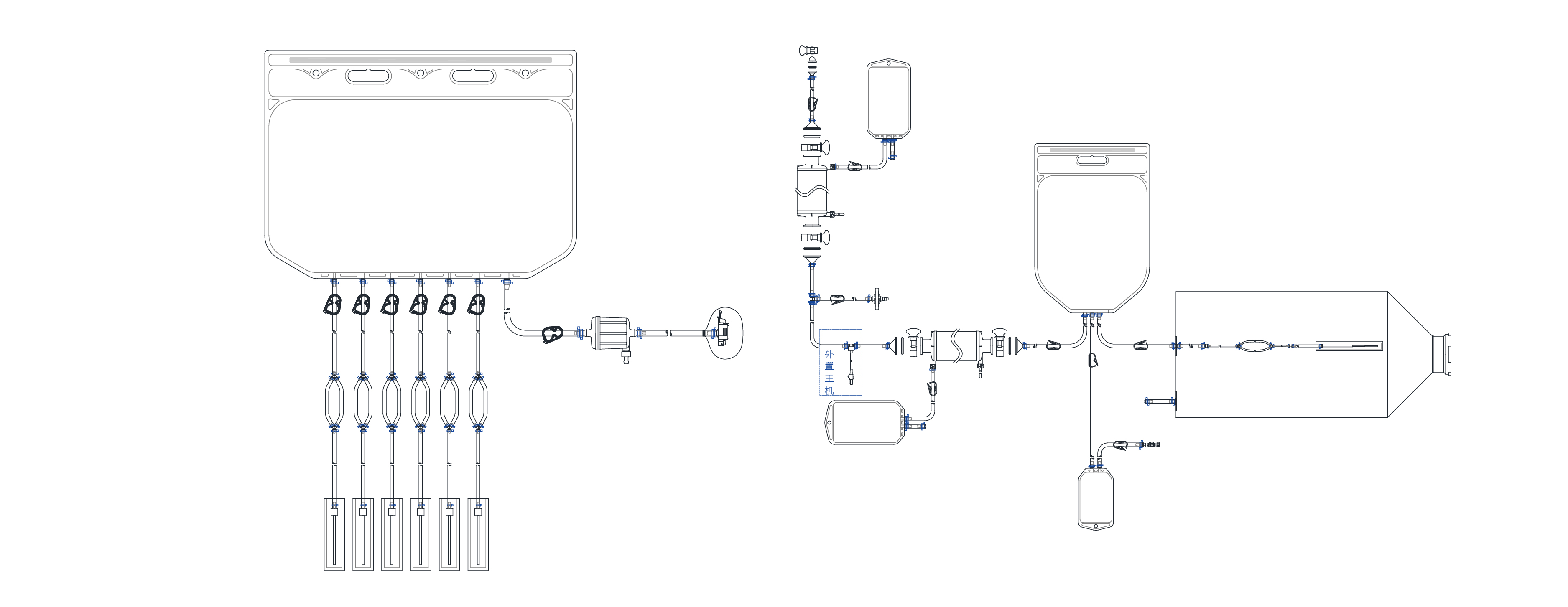
液体の移送とろ過: LifecubeTM SA シングルユースコンポーネント

原料液の調製、保管、移送:Cobetter LifecubeTM シングルユース液体保管バッグ/サンプリングバッグ/ミキシングバッグ
培地のサンプリングと調製、バッファーのサンプリングと調製、細胞/中間生成物の保存、プラスミド生産の採取/精製/調製、ウイルスの精製/保存、細胞液のサンプリング、細胞生成物の凍結保存およびその他の用途にも安心して使用できます。カスタマイズの要望にも迅速に対応でき、包括的な製品バリデーションも可能です。生産の品質管理が厳格であり、さまざまなシングルユースシステム・ハードウェアをカスタマイズことができ、CGTプロセスの流体アプリケーションのニーズを満たすことができます。
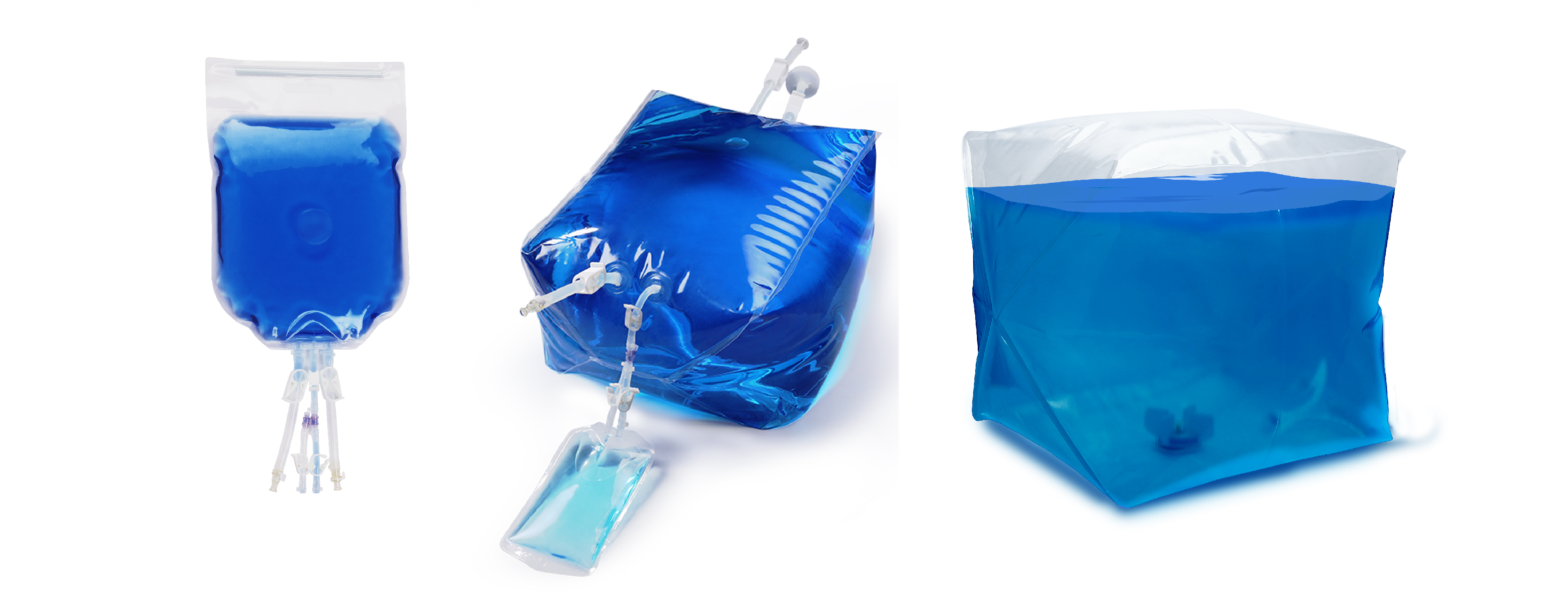
製品の充填: Cobetter LifecubeTM シングルユース充填バッグ
 eShop
eShop



