近年、バイオ医薬品の製造プロセスにおいて、エンドトキシン除去が注目の話題となっています。高濃度濃縮およびろ過後にエンドトキシン濃度が過剰になる問題は、バイオ医薬品研究者の関心の的となっています。
エンドトキシンの紹介
エンドトキシンはリポ多糖類 (LPS) であり、その単位は EU です。エンドトキシンはグラム陰性菌の細胞壁の外膜の外部脂質の主成分であり、細胞が死滅するか破壊されるときに放出されます。エンドトキシンは血液またはCSF(脳脊髄液)に入ると発熱を引き起こすため、発熱物質とも呼ばれます。関連する規制では、医薬品、生物注射剤、および一部の組織培養培地の製造中にエンドトキシン除去の措置を施す必要があると規定されています。
エンドトキシンを効果的に除去する方法?
エンドトキシンは負に帯電したリン酸基とカルボキシル基を含むため、そのモノマーの等電点は約2と比較的低いです。つまり、エンドトキシンはpH > 2の溶液中で電気陰性度を示すため、イオン交換クロマトグラフィーは、タンパク質に対して一般的に使用される脱パイロジェン法の1つの技術です。
しかし、従来の充填剤クロマトグラフィー法には欠点があり、エンドトキシン除去ステップでの応用も制限されます。これらには、パッキンの乱流、煩雑な操作、低流量、長い再生時間、限られた化学的安定性などの取り扱いおよび使用上の問題が含まれます。流速が低く、汚れがつきやすいということは、大規模生産の精製ステップに従来のクロマトグラフィーを組み込むのが面倒で高価であることを意味します。
この厄介な問題に対応するために、Cobetterは、大容量で拡張性があり、すぐに使用できる Purcise Q 強イオン交換吸着膜技術を開発し、発売しました。当社のメンブレンアドソーバーは、高流量、高負荷容量、容易な操作を特徴としており、ラボから生産プロセスまでのエンドトキシン除去のスケールアップのニーズを満たすことができます。

Cobetterの応用事例
10KDa TFFカセットを使用したタンパク質濃縮のアプリケーションでは、濃縮とろ過が進行するにつれて、サンプルおよびバッファー中のエンドトキシンが徐々に濃縮されることがわかりました。また、濃縮プロセス中に、エンドトキシンはタンパク質への吸着を増加させ、最終的に除去するのが困難になります。
Cobetter上記の状況を踏まえ、Cobetterは直ちに社内研究を開始し、新たなエンドトキシン除去アイデアを提案しました。Purcise™ Q メンブレンアドソーバーを使用して、サンプルと液体置換用バッファーをそれぞれ前処理してからサンプルを濃縮することです。プロセスの最初の段階でエンドトキシンを管理し、濃縮およびバッファー交換後のエンドトキシン残留物が許容範囲内に留まるようにします。
研究背景
市場調査によると、高濃度製剤ではエンドトキシンが検出限界を超えたり、それに近づくケースがあります。具体的には、10kDa TFFカセットを使用して、最初の濃縮、ろ過、濃縮の順に最終溶液を得る場合、最終溶液中の残留エンドトキシンが複数のバッチで品質限界に近づいたり、品質限界を超えたりします。さらに、一部のケースでは、Purcise™ Q メンブレンアドソーバーを直接使用して濃縮原液からエンドトキシンを直接除去を試みましたが、エンドトキシン除去効果はありません。
CobetterのR&Dアプリケーションチームによる予備分析によると、この現象は高濃度のタンパク質とエンドトキシンの吸着によって引き起こされ、それによって電荷分布が変化し、最終的にはエンドトキシンの電荷吸着の失敗につながるとのことがわかりました。
上記の状況に基づいて、Cobetterは綿密なテストと研究を行いました:
実験一:緩衝液条件の影響
エンドトキシンチャレンジ溶液は、タンパク質緩衝液中の同じ成分(ヒスチジン、マンノース、および Tween系)に従って調製されました。緩衝液には界面活性剤 Tween が含まれているため、実験ではエンドトキシン除去における Purcise™ Q メンブレンアドソーバーに対する Tween の影響も個別に調査しました。
- チャレンジバッファー 1 : UF/DF バッファー (Tween を除去)、標準エンドトキシン溶液を追加し、最終濃度 3 EU/ml のチャレンジ溶液を調製します
- チャレンジバッファー 2: UF/DF バッファー (Tween を含む)、標準エンドトキシン溶液を追加し、最終濃度 3 EU/ml のチャレンジ溶液を調製します
両方のチャレンジバッファーを、0.9mlのPurcise™ Q シリンジメンブレンアドソーバーを使用して、流速9mL/minで90mLろ過しました。
テスト結果は次のとおりです:
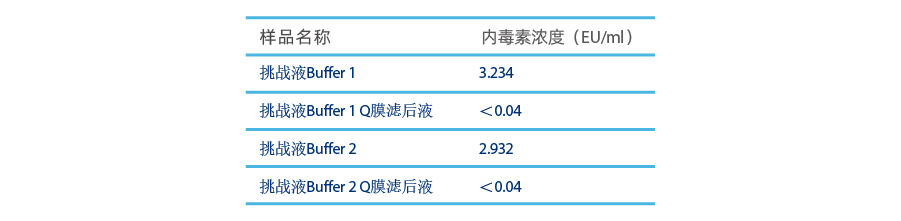
テスト結果は、緩衝液成分がPurcise™ Q メンブレンアドソーバーのエンドトキシン除去性能に影響を及ぼさないことを示しています。
実験二:バッファー中の微量エンドトキシンの影響
バッファー(ヒスチジン、マンノース、Tween システム)を 10kDa TFF カセットを使用して直接濃縮し、濃縮バッファー中の残留エンドトキシンを検出します。
4L UF/DF 交換バッファーを準備し、2 つに分けます:
- 実験グループ: 2L のバッファーを 5ml Purcise™ Q シリンジメンブレンアドソーバーで 10 MV/min でろ過します (残留エンドトキシンを検出するために 1L と 2L をろ過した際の即時サンプリング)。ろ過した溶液を濃縮し、それぞれ10倍と40倍の濃度で残留エンドトキシンを検出するためにサンプリングします
- コントロールグループ: 2L のバッファーを直接濃縮し、10 倍および 40 倍の濃度でサンプして残留エンドトキシンを検出します
テスト結果は次のとおりです:
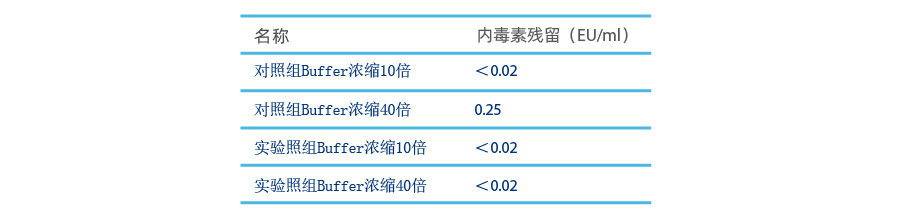
比較実験から、バッファーに医薬品グレードの材料が使用され、調製された溶液が品質要件を満たしている場合でも、濃縮プロセス中に微量のエンドトキシンが徐々に蓄積し、最終製品の品質に影響を与えることがわかります。特に高濃縮工程では、エンドトキシン超過リスクが急激に増加します。 Purcise™ Q メンブレンアドソーバーを使用すると、バッファー中の微量のエンドトキシンを効果的に制御して、濃縮プロセス中にエンドトキシンが基準を超えるリスクを軽減できます。
実験三:限外ろ過前の供給液中のエンドトキシン制御
濃縮前に、タンパク質サンプルと緩衝液(ヒスチジン、マンノース、Tween システム)をPurcise™ Q メンブレンアドソーバーで別々にエキドトキシンをコントロールし、濃縮して最終溶液を得ました。
サンプル調製:
1. タンパク質サンプル調製: 1Lのタンパク質サンプル (濃度:~8.0g/L) を0.9ml Purcise™ Q シリンジメンブレンアドソーバーで流量 4.5mL/minでろ過し、遊離エンドトキシンを除去します。ろ過後の残留エンドトキシンは<0.05EU/mLです;
2. UF/DF バッファー調製: 5Lの調製バッファーを5ml Purcise™ Q シリンジメンブレンアドソーバーで流量 50mL/min (5 MV/min) でろ過し、微量エンドトキシンを除去します。ろ過後の残留エンドトキシンは<0.02 EU/mlです。
タンパク質を濃縮し、ろ過後、濃縮します:
1L のタンパク質溶液を 5 倍濃縮し、UF/DF バッファーを使用して 8 倍量交換します。交換が完了したら、3 倍濃縮を行って最終溶液を得ます。交換後の 2 回目の濃縮プロセスでは、セグメントごとにサンプリングして残留エンドトキシンを検出します。
テスト結果は下記のとおりです:

*この実験のコントロールグループ: タンパク質を濃縮-洗浄-ろ過の流れで処理して最終溶液を得します。最終溶液中のエンドトキシンは >1 EU/ml であることが検出されました。
実験結果によると、Purcise™ Q メンブレンアドソーバーを使用してUF/DFプロセスでエンドトキシンを最初から制御した後、最終的なエンドトキシンを0.5 EU/ml以内に制御でき、以前と比較して大幅に減少することができました。このソリューションは、製品の品質を向上させると同時に、プロセス中の毒素汚染のリスクも軽減します。
従って、高濃縮とバッファー交換工程では、濃縮前にサンプルと交換用バッファーにPurcise™ Q メンブレンアドソーバーを使用し、プロセスの前段階からエンドトキシンを制御することをお進めます。プロセスの最初からのエンドトキシンを管理し、最終濃度およびバッファー交換後にエンドトキシン残留物が許容範囲内に留まるようにします。
 eShop
eShop
